La Química.
La Química es la ciencia que estudia las sustancias que
conforman el universo y de los cambios que estos mismos experimentan. Su campo
es muy amplio, ya sea por la diversidad de estructuras de la materia y de los
cambios químicos, como por su utilidad. Se integra como una ciencia
multidisciplinaria como la biología o la física, también es eminente y
experimental y para aplicarla es necesario del desarrollo del método científico.
Por lo que se ha convertido en una herramienta primordial al momento de
resolver grandes preguntas de la humanidad, así mismo generando respuestas a
sus necesidades.
Origen de la Química
 |
| Homo Erectus haciendo fuego. |
 |
| Edad del bronce. |
 |
| Alquimista. |
 |
| Imagen de Linus Pauling. |
El científico Linus Pauling propuso la siguiente definición:
“La Química es la ciencia que estudia las sustancias, su estructura, sus
propiedades y las reacciones que las transforman en otras sustancias”.
La materia
La materia es todo aquello que ocupa un lugar determinado en el espacio, posee una cantidad determinada de energía y está sujeto a interacciones en el tiempo, los cuales pueden ser medidos por algún instrumento de medición. Desde la química, la materia es el conjunto de los elementos que constituyen la realidad perceptible, entre otras palabras, constituye las sustancias a nuestro alrededor y a nosotros mismos, por lo que la química se ocupa de estudiar la composición y transformación de la materia. Hasta donde sabemos la materia está constituida por partículas microscópicas, a las que llamamos átomos. Estos constituyen las unidades fundamentales de la materia. Cada uno de los átomos tienen propiedades de elementos químicos a la que pertenece, estos los podemos encontrar en la Tabla Periódica.
Propiedades de la materia
Las propiedades de la materia se clasifican en dos grandes grupos:
Propiedades físicas de la materia, son caracteristicas que se pueden observar y medir son la necesidad de cambiar su estado:
 |
| Temperatura. |
- Temperatura, es el grado de calor que presenta un material en un momento.
- Estado de agregación, determinado por la temperatura y la presión sometida "Sólido, Líquido y Gaseoso".
- Conductividad, capacidad que tiene los materiales para permitir el transito de energía a través de sus particulas "Termica o Electrica".
- Punto de fusión, es la temperatura a la que un sólido se transforma en un líquido.
- Punto de ebullición, es la temperatura en que un líquido se transforma en gas.
 |
| Reactividad. |
- pH, la corrosividad de los ácidos y la causticidad de as bases "Acidez o alcalinidad".
- Reactividad, la materia puede ser más o menos reactiva "ser propensa a cambiar de sustancia".
- Inflamabilidad, pueden generar una explosión que libere calor y producir llamas.
- Oxidación, es la pérdida de electrones.
- Redducción, es la ganacia de electrones.
Clasificación de la materia
Existen diversas formas y criterios para clasificar la materia, pero los principales son:
 |
| Materia Viva. |
- Materia viviente, la conforma los seres vivos.
- Materia inanimada, la compone objetos inertes o sin vida.
- Materia orgánica, es conformada principalmente por átomos de carbono e hidrógeno.
- Materia inorgánica, son reacciones químicas espontáneas o no espontáneas.
- Materia simple, son compuestos muy cercanos a la pureza.
- Materia compuesta, tienen diversos tipos de elementos.
Las Mezclas
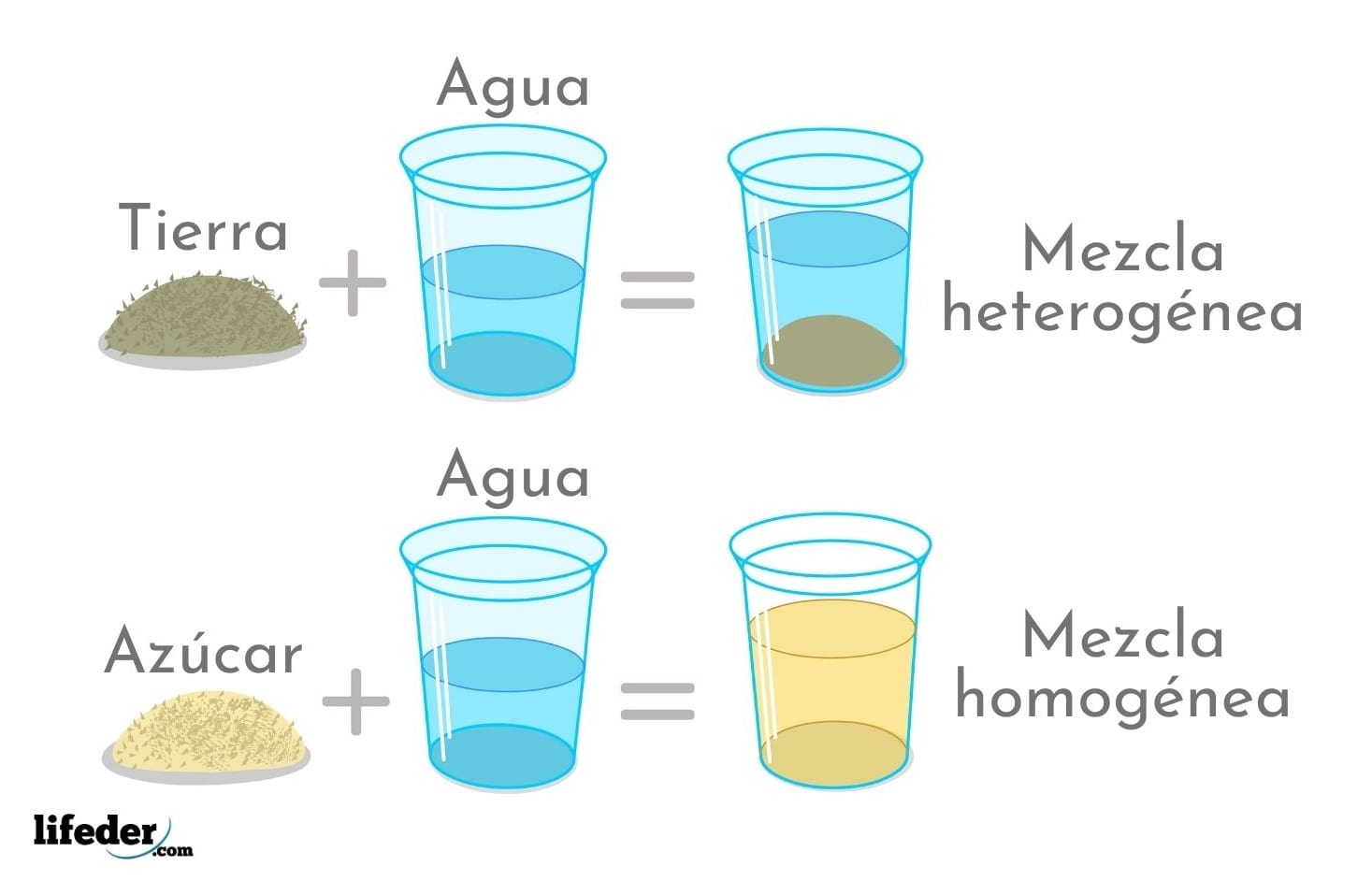 |
| Mezclas homogéneas y heterogéneas. |
Los dos principales tipos de mezclas son:
Mezcla homogénea, sus componentes no se distinguen a simple
vista, es necesario usar una lupa o un microscopio, ya que estas se integran
uniformemente.
Mezcla heterogénea, se pueden distinguir a simple vista cada uno de sus componentes.
Características de las mezclas
Sus componentes se pueden separar, las mezclas se generan
por la combinación de sustancias bajo ciertas condiciones, por lo que, también se
pueden separar en sus componentes individuales y recuperarlos aplicando procedimientos
físicos de separación.
 |
| Mezclas. |
No forman enlaces químicos, una mezcla no es una reacción química,
por lo que no se origina a consecuencia de reacciones.
Pueden ser radiactivas, algunas mezclas pueden resultar
reactivas bajo ciertas condiciones.
No tiene formula química, estas no se pueden representar mediante
una formula química, las mezclas no tienen formula que las definan.
Pueden tener una o más fases, en las mezclas existen al menos dos fases, fase dispersa y fase dispersante.
Métodos de separación de mezclas
Una mezcla puede ser definida como tal solo cuando se pueden
volver a obtener las sustancias individuales aplicando procedimientos físicos de
separación, algunos de estos son:
 |
| Métodos de separación de mezclas. |
Decantación, se usa para separar solidos suspendidos en
líquidos y también líquidos inmiscibles.
Destilación, se usa para separar mezclas líquidas, este se logra a través de diferentes tipos de ebullición.
Ley de conservación de la materia
 |
| Ley de conservación de la materia. |
“Nada se pierde, anda se crea, todo se transforma” o “La
materia no se crea ni se destruye, solo se transforma”.
Fue elaborada independientemente por Mijaíl Lomonósov en 1745 y Antoine Lavoisier en 1785, esta ley es fundamental para una adecuada comprensión de la química. Está detrás dela descripción habitual de las reacciones químicas mediante la ecuación química.
Ley de propociones definidas
La Ley de Proporciones Definidas o también conocida como Ley
de Proporciones Constantes y es una ley propuesta por Louis Proust en 1799 y
que afirma:
 |
| Ejemplo de la "Ley de proporciones definidas". |
Esto da a entender que, en una determinada reacción, los reactivos se van a combinar siempre en el mismo porcentaje de peso independientemente de si la cantidad es grande o pequeña. Esta ley tiene implicaciones importantes, ya que a la hora de determinar una formula molecular de un compuesto, podemos asegurarnos que los subíndices de cada elemento son fijos.
Ley de proporciones múltiples
La Ley de Proporciones Múltiples fue propuesta por John
Dalton, en el año de 1803 y es una ley muy importante en la estequiometria. Fue
demostrada en el practica por el químico francés Gay-Lussac. Esta ley indica
que cuando dos elementos A y B son capaces de combinarse entre sí para formar varios
compuestos distintos, las distintas masas B que se unen a una cierta masa de A,
están en relación de números enteros y sencillos.
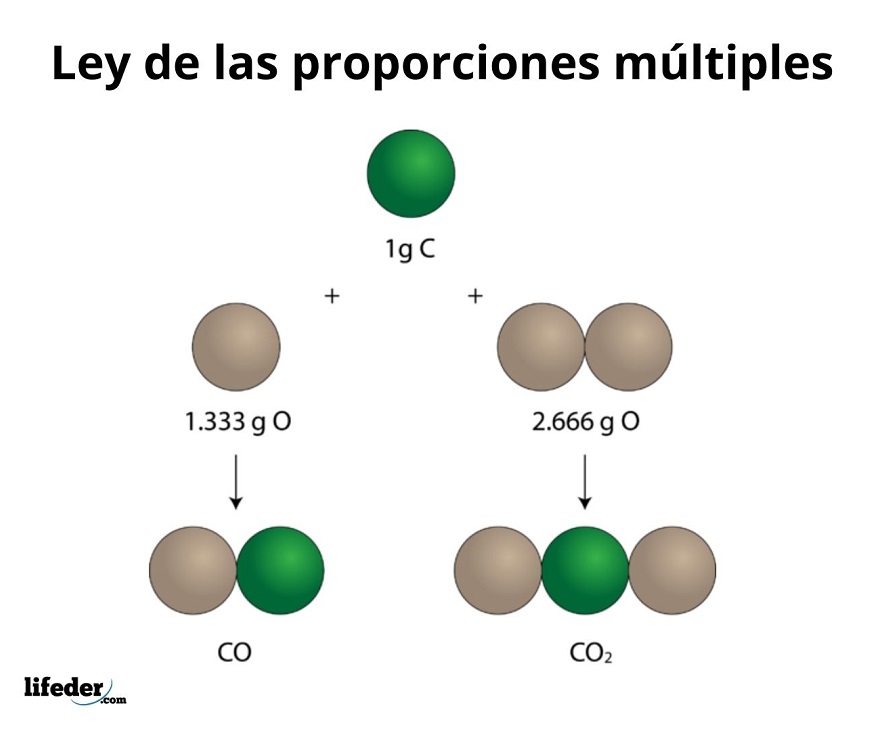 |
| Ejemplo de la "Ley de proporciones multiples". |
Conclusión
Entonces, la química es esa ciencia que estudia las
estructuras, propiedades y transformaciones de la materia, que están sujetas a
diferentes leyes que las rigen a partir de su propia estructura atómica.
También que es indispensable el uso del método científico para el estudio de las
sustancias, propiedades, la estructura de la materia, las reacciones de un
metal con oxígeno, la combustión, etc. Son algunas de las características que
se estudian en la química.
Referencias
RANGEL OLVERA, L. M. (2019). HISTORIA DE LA QUÍMICA. prepa.chapingo.mx. Recuperado 1 de mayo de 2022, de http://prepa.chapingo.mx/wp-content/uploads/2019/09/HISTORIA-DE-LA-QU%C3%8DMICA.pdf
Materia - Concepto, propiedades, clasificación y ejemplos.
(s. f.). Concepto. Recuperado 1 de mayo de 2022, de https://concepto.de/materia/
Mezclas: tipos, separación, ejemplos y características. (s.
f.). Características. Recuperado 1 de mayo de 2022, de https://www.caracteristicas.co/mezclas/
QUÍMICA. (s. f.). dems. Recuperado 1 de mayo de 2022, de
https://app.dems.ipn.mx/guia/sistema/contenido/QU%C3%8DMICA.html#:%7E:text=Qu%C3%ADmica%20es%20la%20ciencia%20que,cambios%20que%20en%20ella%20ocurren.
Las Leyes Ponderales. (s. f.). Quimicas. Recuperado 1 de
mayo de 2022, de https://www.quimicas.net/2015/09/las-leyes-ponderales.html
Ley de la Conservación de la Materia. (2018, 13 noviembre).
Clickmica. Recuperado 1 de mayo de 2022, de https://clickmica.fundaciondescubre.es/conoce/descubrimientos/ley-la-conservacion-la-materia/
Ley de las Proporciones Definidas. (s. f.). Quimicas.
Recuperado 1 de mayo de 2022, de https://www.quimicas.net/2015/10/ley-de-las-proporciones-definidas.html
Ley de las proporciones múltiples | La Guía de Química.
(2010, 18 octubre). La Guia. Recuperado 1 de mayo de 2022, de https://quimica.laguia2000.com/conceptos-basicos/ley-de-las-proporciones-multiples